Εστέρας εναντίον Αιθέρα
Περιεχόμενο
- Περιεχόμενο: Διαφορά μεταξύ του εστέρα και του αιθέρα
- Τι είναι ο Έστερ;
- Τι είναι ο Αιθέρας;
- Βασικές διαφορές
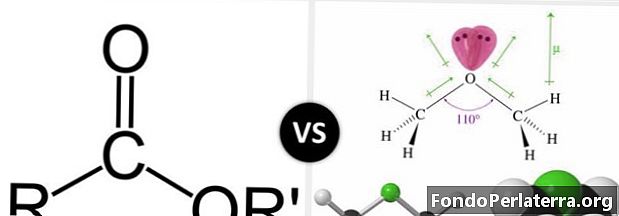
Ο εστέρας και ο αιθέρας είναι οργανικά μόρια με άτομα οξυγόνου. Και οι δύο έχουν την αιθερική σύνδεση που είναι -Ο-. Οι εστέρες έχουν την ομάδα -COO. Ένα άτομο οξυγόνου δεσμεύεται στον άνθρακα με έναν διπλό δεσμό και το άλλο οξυγόνο δεσμεύεται με έναν απλό δεσμό. Δεδομένου ότι μόνο τρία άτομα συνδέονται με το άτομο άνθρακα, έχει τριγωνική επίπεδη γεωμετρία γύρω από αυτό. Περαιτέρω, το άτομο άνθρακα είναι sp2υβριδοποιήθηκε.

Η καρβοξυλομάδα είναι μια ευρέως εμφανιζόμενη λειτουργική ομάδα στη χημεία και τη βιοχημεία. Αυτή η ομάδα είναι η μητρική της σχετικής οικογένειας ενώσεων που είναι γνωστές ως ενώσεις ακυλίου. Οι ενώσεις ακυλίου είναι επίσης γνωστές ως παράγωγα καρβοξυλικού οξέος. Ο εστέρας είναι ένα παράγωγο καρβοξυλικού οξέος όπως αυτό. Ο εστερικός εστέρας έχει δεσμό άνθρακα-καρβονυλ-οξυγόνου, ενώ η αιθερική ένωση έχει δεσμό άνθρακα-οξυγόνου-άνθρακα.
Περιεχόμενο: Διαφορά μεταξύ του εστέρα και του αιθέρα
- Τι είναι ο Έστερ;
- Τι είναι ο Αιθέρας;
- Βασικές διαφορές
- Εξήγηση βίντεο
Τι είναι ο Έστερ;
Οι εστέρες έχουν έναν γενικό τύπο RCOOR '. Οι εστέρες παρασκευάζονται με την αντίδραση μεταξύ ενός καρβοξυλικού οξέος και μιας αλκοόλης. Οι εστέρες ονομάζονται γράφοντας πρώτα τα ονόματα του μέρους που προέρχεται από αλκοόλη. Στη συνέχεια, το όνομα που προέρχεται από το οξύ μέρος είναι γραμμένο με το τέλος -έφαγε ή -ω.

Τι είναι ο Αιθέρας;
Οι αιθέρες έχουν τη λειτουργική ομάδα ROR, π.χ. Αιθοξυπροπάνιο. Ο αιθέρας είναι μια ένωση που έχει δεσμό άνθρακα οξυγόνου-άνθρακα. Οι αιθέρες μπορούν να παραχθούν με διαμοριακή αφυδάτωση αλκοολών. Αυτό συνήθως λαμβάνει χώρα σε χαμηλότερη θερμοκρασία από την αφυδάτωση στο αλκένιο.

Βασικές διαφορές
- Οι εστέρες είναι παράγωγα καρβοξυλικού οξέος και έχουν την ομάδα -COO. Οι αιθέρες έχουν την -Ο- λειτουργική ομάδα.
- Ο εστέρας έχει ομάδα καρβονυλίου πλησίον του -Ο-οξυγόνου, αλλά ο αιθέρας δεν έχει τέτοια.
- Οι εστέρες έχουν τόσες πολλές χαρακτηριστικές μυρωδιές.
- Οι εστέρες υδρολύονται εύκολα για να παράγουν αλκοόλη και ένα καρβοξυλικό οξύ σε αντίθεση με τους αιθέρες.
- Οι εστέρες έχουν τη λειτουργική ομάδα RCOOR με έναν διπλό δεσμό C σε ένα από τα Os και έναν απλό δεσμό με τον άλλο Ο. π.χ. Αιθανοϊκός αιθυλεστέρας. Ενώ οι αιθέρες έχουν τη λειτουργική ομάδα ROR π.χ. Αιθοξυπροπάνιο
- Ο αιθέρας είναι μια ένωση που έχει δεσμό άνθρακα οξυγόνου-άνθρακα. Ένα παράδειγμα αιθέρα είναι ένα αιθοξυλιωμένο. Η ένωση που ακολουθεί είναι laureth 5. Ένας εστέρας, από την άλλη πλευρά, είναι μια ένωση που έχει δεσμό άνθρακα-άνθρακα-οξυγόνου άνθρακα.
- Το κύριο χαρακτηριστικό που διακρίνει τον εστέρα από τον αιθέρα είναι η διαφορετική δομή τους. Η ένωση γνωστή ως εστέρας έχει δεσμό άνθρακα-καρβονυλίου-οξυγόνου, ενώ η αιθερική ένωση έχει δεσμό άνθρακα-οξυγόνου-άνθρακα.
- Οι εστέρες είναι πολικές ενώσεις, αλλά δεν έχουν την ικανότητα να σχηματίζουν ισχυρούς δεσμούς υδρογόνου μεταξύ τους λόγω της έλλειψης δεσμού υδρογόνου προς το οξυγόνο. Ως αποτέλεσμα, οι εστέρες έχουν χαμηλότερα σημεία βρασμού σε σύγκριση με οξέα ή αλκοόλες με παρόμοια μοριακά βάρη. Οι αιθέρες μπορούν να παραχθούν με διαμοριακή αφυδάτωση αλκοολών. Αυτό συνήθως λαμβάνει χώρα σε χαμηλότερη θερμοκρασία από την αφυδάτωση στο αλκένιο. Η σύνθεση Williamson είναι μια άλλη μέθοδος για την παραγωγή ασύμμετρων αιθέρων.