Κατιόν εναντίον ανιόντος
Περιεχόμενο
- Περιεχόμενο: Διαφορά μεταξύ κατιόντων και ανιόντων
- Συγκριτικό διάγραμμα
- Τι είναι τα κατιόντα;
- Τι είναι τα ανιόντα;
- Βασικές διαφορές
- συμπέρασμα
Η διαφορά μεταξύ του κατιόντος και του ανιόντος είναι ότι το κατιόν περιέχει ένα θετικό φορτίο σε αυτό, ενώ ένα ανιόν παρουσιάζει αρνητικό φορτίο σε αυτό.

Το κατιόν και το ανιόν είναι άτομα που έχουν φορτίο πάνω τους. Εδώ θα γνωρίσουμε τις διαφορές μεταξύ των δύο αυτών φορτισμένων σωματιδίων. Τα κατιόντα παρουσιάζουν θετική φόρτιση σε αυτά, ενώ το ανιόν παρουσιάζει αρνητικό φορτίο.
Η λέξη «κατιόν» λαμβάνεται από την ελληνική λέξη «kata» που σημαίνει κάτω. Ενώ η λέξη ανιόν προέρχεται από την ελληνική λέξη "ano" που σημαίνει επάνω. Τα κατιόντα είναι πάντα ελκυστικά προς την κάθοδο που είναι ένα αρνητικά φορτισμένο ηλεκτρόδιο ενώ τα ανιόντα πάντα προσελκύονται προς την άνοδο που είναι ένα θετικά φορτισμένο ηλεκτρόδιο.
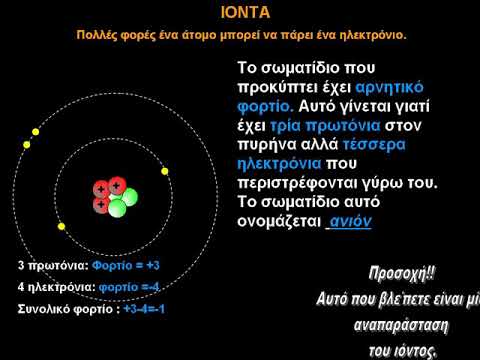
Τα κατιόντα σχηματίζονται όταν ένα άτομο χάνει το ένα ή περισσότερα ηλεκτρόνια του και επομένως το θετικό φορτίο εμφανίζεται στο άτομο που γίνεται κατιόν τότε. Ένα ανιόν σχηματίζεται όταν ένα άτομο αποκτά ένα ή περισσότερα ηλεκτρόνια και έτσι γίνεται αρνητικά φορτισμένο. Τα κατιόντα σχηματίζονται από τα άτομα των μετάλλων ενώ τα ανιόντα σχηματίζονται από τα στοιχεία των μη-μετάλλων. Στα κατιόντα, ο αριθμός των πρωτονίων είναι μεγαλύτερος από τον αριθμό των ηλεκτρονίων και γι 'αυτό παρουσιάζει θετική φόρτιση. Στο ανιόν, ο αριθμός των ηλεκτρονίων είναι μεγαλύτερος από τα πρωτόνια και γι 'αυτό παρουσιάζουν αρνητικό φορτίο.
Σε μια χημική αντίδραση, τα κατιόντα αντιδρούν με ανιόντα για να σχηματίσουν μια ιοντική ένωση. Ένα κατιόν δεν μπορεί ποτέ να αντιδράσει με ένα κατιόν και ένα ανιόν δεν μπορεί ποτέ να αντιδράσει με ένα ανιόν. Η ακτίνα ενός κατιόντος είναι πάντα μεγαλύτερη από την ακτίνα ενός ανιόντος επειδή, σε κατιόντα, οι τροχιές χάνονται με την απώλεια των ηλεκτρονίων ενώ βρίσκονται στα ανιόντα, ο αριθμός τροχιάς αυξάνεται με την αύξηση των ηλεκτρονίων. Ένα κατιόν το οποίο παρουσιάζει ένα θετικό φορτίο δηλώνεται με ένα δείκτη + μετά το όνομα του στοιχείου ή χημικού τύπου μιας ένωσης, π.χ. Fe2 + και NH4 +. Ένα ανιόν επίσης συμβολίζεται με τον ίδιο τρόπο με ένα δείκτη - μετά το όνομα του στοιχείου ή χημικού τύπου μιας ένωσης, π.χ. Br-N3- κλπ. Τα παραδείγματα των κατιόντων είναι ο σίδηρος (Fe2 + και Fe3 +), το νάτριο (Na + ), καλίου (Κ +) και μαγνησίου (Mg2 +). Τα παραδείγματα ανιόντων είναι χλωριούχο (Cl-), φθοριούχο (F-), βρωμιούχο (Br-), υδρίδιο (Η-) και νιτρίδιο (Ν-).
Περιεχόμενο: Διαφορά μεταξύ κατιόντων και ανιόντων
- Συγκριτικό διάγραμμα
- Τι είναι τα κατιόντα;
- Τι είναι τα ανιόντα;
- Βασικές διαφορές
- συμπέρασμα
Συγκριτικό διάγραμμα
| Βάση | Κατιόν | Ανιόν |
| Ορισμός | Είναι το είδος των σωματιδίων που παρουσιάζουν θετικό φορτίο. | Είναι το είδος των σωματιδίων που παρουσιάζουν αρνητικό φορτίο. |
| Γιατί έχουν χρέωση; | Έχουν θετικό φορτίο επειδή χάνουν ένα ή περισσότερα ηλεκτρόνια. | Έχουν αρνητικό φορτίο επειδή κερδίζουν ένα ή περισσότερα ηλεκτρόνια. |
| Προέλευση των λέξεων | Η λέξη κατιόν προέρχεται από την ελληνική λέξη "kata" που σημαίνει κάτω. | Η λέξη ανιόν προέρχεται από την ελληνική λέξη "ano" που σημαίνει κάτω. |
| Αναλογία ηλεκτρονίου προς πρωτονία | Εμφανίζουν θετική φόρτιση επειδή ο αριθμός των πρωτονίων είναι μεγαλύτερος από τον αριθμό των ηλεκτρονίων που υπάρχουν σε αυτά | Εμφανίζουν αρνητική φόρτιση επειδή ο αριθμός των ηλεκτρονίων είναι μεγαλύτερος από τον αριθμό των πρωτονίων σε αυτά. |
| Τύπος ατόμων | Αποτελούνται από τα άτομα των μετάλλων | Δημιουργούνται από τα άτομα των μη-μεταλλικών. |
| Προσέλκυση ηλεκτροδίων | Τρέφονται προς το αρνητικά φορτισμένο ηλεκτρόδιο, δηλ. Για την κάθοδο. | Τρέφονται προς το θετικά φορτισμένο ηλεκτρόδιο, δηλ. Προς την άνοδο. |
| Πώς σημαίνονται | Σηματοδοτούνται από το δείκτη + μετά το όνομα του στοιχείου ή χημικού τύπου της ένωσης. | Ονομάζονται από τον δείκτη - μετά το όνομα του στοιχείου ή χημικού τύπου της ένωσης. |
| Ακτίνα κύκλου | Η ακτίνα των κατιόντων είναι μικρότερη επειδή ο αριθμός των τροχιών μειώνεται λόγω της απώλειας ηλεκτρονίων | Η ακτίνα των ανιόντων είναι μεγαλύτερη από την ακτίνα των κατιόντων επειδή ο αριθμός των τροχιών αυξάνεται με το κέρδος των ηλεκτρονίων. |
| Χημική αντίδραση | Σε μια χημική αντίδραση, αντιδρούν με ανιόντα για να σχηματίσουν ιοντικές ενώσεις | Σε μια χημική αντίδραση, αντιδρούν με κατιόντα για να σχηματίσουν ιοντικές ενώσεις. |
| Μην αντιδράτε με | Δεν προσελκύουν ή αντιδρούν με θετικά φορτισμένα σωματίδια | Δεν προσελκύουν ή αντιδρούν με θετικά φορτισμένα σωματίδια |
| Παραδείγματα | Τα παραδείγματα κατιόντων μπορούν να δοθούν ως σίδηρος (Fe2 + και Fe3 +), ασβέστιο (Ca2 +), κάλιο (Κ +), Al3 + αλουμίνιο) και ιόν αμμωνίου (NH4 +) κ.λπ. | Τα παραδείγματα ανιόντων μπορούν να δοθούν ως βρωμίδιο (Br-), χλωρίδιο (Cl-), νιτρίδιο (Ν-) και υδρίδιο (Η-), κλπ. |
Τι είναι τα κατιόντα;
Τα κατιόντα είναι θετικά φορτισμένα σωματίδια. Αυτά σχηματίζονται όταν ένα άτομο ενός στοιχείου χάνει ένα ή περισσότερα ηλεκτρόνια. Τα άτομα κάνουν έτσι ώστε να κερδίσουν σταθερότητα. Με άλλα λόγια, θέλουν να πάρουν τη σειρά των ευγενών αερίων που είναι τα πιο σταθερά στοιχεία του σύμπαντος. Η λέξη κατιόν προέρχεται από την ελληνική λέξη "kata" που σημαίνει κάτω. Σε ένα κατιόν, ο αριθμός των πρωτονίων είναι μεγαλύτερος από τον αριθμό των ηλεκτρονίων. Όπως γνωρίζουμε, τα πρωτόνια διαθέτουν θετικό φορτίο και τα ηλεκτρόνια διαθέτουν αρνητικό φορτίο. Λόγω του μεγαλύτερου αριθμού θετικά φορτισμένων σωματιδίων, τα κατιόντα παρουσιάζουν θετική φόρτιση. Τα κατιόντα σχηματίζονται πάντα από τα μέταλλα των ατόμων. Ο λόγος είναι ότι τα μέταλλα έχουν την τάση να χάσουν ηλεκτρόνια. Μια μεταλλική επιφάνεια έχει έναν αμέτρητο αριθμό ελεύθερων ηλεκτρονίων πάνω σε αυτήν. Έτσι, τα μέταλλα χάνουν ηλεκτρόνια και τα άτομα τους υπάρχουν υπό μορφή κατιόντων.
Τα κατιόντα πάντα προσελκύονται από την κάθοδο που είναι αρνητικό ηλεκτρόδιο. Σε μια χημική αντίδραση, τα κατιόντα αντιδρούν πάντα με τα ανιόντα για να σχηματίσουν ιοντικές ενώσεις. Ένα καλύτερο παράδειγμα αυτού του τύπου αντίδρασης είναι ο σχηματισμός κοινού αλατιού, δηλ. Χλωριούχου νατρίου (NaCl) στο οποίο το νάτριο είναι κατιόν και το χλωρίδιο είναι ανιόν. Τα παραδείγματα κατιόντων μπορούν να δοθούν ως νάτριο (Na +), κάλιο (Κ +), λίθιο (Li +), μαγνήσιο (Mg2 +) και αργίλιο (Al3 +). Ένα παράδειγμα μεταξύ των θετικά φορτισμένων ενώσεων είναι το ιόν αμμωνίου (ΝΗ4 +).
Τι είναι τα ανιόντα;
Τα ανιόντα είναι τα άτομα που έχουν αρνητικό φορτίο. Εμφανίζουν αρνητικό φορτίο επειδή τα άτομα αποκτούν ένα ή περισσότερα ηλεκτρόνια για να κερδίσουν σταθερότητα. Έτσι, ο αριθμός των ηλεκτρονίων γίνεται μεγαλύτερος από τον αριθμό των πρωτονίων στα άτομα αυτά και παρουσιάζουν αρνητικό φορτίο. Κυρίως τα άτομα των μη μεταλλικών εμφανίζουν αυτή την τάση. Παρουσιάζουν αυτόν τον τύπο συμπεριφοράς για να ακολουθήσουν τα ευγενή αέρια που είναι το πιο σταθερό στοιχείο αυτού του σύμπαντος.
Τα ανιόντα πάντα προσελκύονται από το θετικό ηλεκτρόδιο, δηλαδή την άνοδο. Σε μια χημική αντίδραση, τα ανιόντα αντιδρούν με κατιόντα για να σχηματίσουν ιοντικές ενώσεις. Η λέξη ανιόν προέρχεται από την ελληνική λέξη "ano" που σημαίνει επάνω. Τα παραδείγματα ανιόντων μπορούν να δοθούν ως θείο (S-), ιόν ιωδίου (Ι-), βρωμίδιο (Br-), χλωρίδιο (Cl-), υδρίδιο (Η-) και νιτρίδιο (Ν-).
Βασικές διαφορές
- Τα κατιόντα είναι εκείνα τα σωματίδια που έχουν θετικό φορτίο ενώ τα ανιόντα είναι εκείνα τα σωματίδια που έχουν αρνητικό φορτίο.
- Τα κατιόντα έχουν την τάση να κινούνται προς ένα αρνητικό ηλεκτρόδιο, δηλ. Την κάθοδο ενώ τα ανιόντα έχουν την τάση να κινούνται προς το θετικό ηλεκτρόδιο, δηλ. Την άνοδο.
- Στα κατιόντα, τα πρωτόνια είναι περισσότερο σε αριθμό από τα ηλεκτρόνια, ενώ στα ανιόντα, τα ηλεκτρόνια είναι περισσότερο σε αριθμό από τα πρωτόνια.
- Τα κατιόντα σχηματίζονται από τα άτομα των μεταλλικών στοιχείων ενώ σχηματίζονται ανιόντα από τα άτομα των μη μεταλλικών στοιχείων.
- Οι τροχιές των ανιόντων είναι μεγαλύτερες από τις τροχιές των κατιόντων.
συμπέρασμα
Κατιόντα και ανιόντα, και τα δύο είναι φορτισμένα σωματίδια. Είναι πολύ σημαντικό για τους σπουδαστές των επιστημών να γνωρίζουν τις διαφορές μεταξύ των δύο. Στο παραπάνω άρθρο μάθαμε σαφείς διαφορές μεταξύ κατιόντων και ανιόντων.